Способы лечения диафрагмальной грыжи

Диафрагмальная грыжа – это транспозиция брюшных органов в полость грудной клетки через отверстие в диафрагме. У некоторых пациентов протекает бессимптомно. Проявляется болью, урчанием в грудной клетке, диспепсией, дисфагией, при больших дефектах – нарушением сердечной деятельности и дыхания. Диагностируется с помощью рентгенографии грудной клетки, эзофагогастроскопии, внутрипищеводной pH-метрии. Для устранения диафрагмальных дефектов используют лапароскопическую фундопликацию, лапаротомную или торакотомную гастропексию, операции Ниссена, Белси, ушивание, пластику, аллопротезирование грыжевого отверстия.
Общие сведения
Диафрагмальные грыжи были впервые описаны французским хирургом Амбруазом Паре в 1579 году, принадлежат к категории часто встречающихся болезней пищеварительного тракта, составляют до 2% всех видов грыжевых образований. Распространенность патологии возрастает от 10% в молодом возрасте до 50% у 50-60-летних пациентов. Заболевание диагностируют у 7-10% больных, предъявляющих жалобы на боли в груди и нарушения сердечной деятельности.
Врожденные грыжевые дефекты диафрагмы являются одной из распространенных причин мертворождения, выявляются у 1 из 2 000-4 000 живорожденных младенцев, часто сочетаются с другими пороками развития, составляют до 8% всех наследственных и дизэмбриогенетических аномалий.
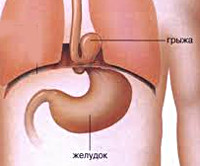
Диафрагмальная грыжа
Причины
Заболевание является полиэтиологическим. Во взрослом возрасте патология зачастую развивается при сочетании нескольких эндогенных или экзогенных провоцирующих факторов, врожденное грыжевое выпячивание формируется в результате генетических мутаций. Специалисты в сфере хирургии и гастроэнтерологии называют следующие группы причин и предпосылок возникновения грыж диафрагмы:
- Аномалии диафрагмальных мышц и пищевода. Недоразвитие отдельных участков и аплазия части диафрагмы может иметь как наследственное, так и дизэмбриогенетическое происхождение. Семейные формы пороков развития, в том числе укорочение пищевода, вероятнее всего наследуются по мультифакторному или аутосомно-рецессивному типу. Грыжи диафрагмальной локализации в сочетании с гипоплазией пальцев, расщеплением неба и верхней губы выявляются у пациентов с синдромом Фринса. Возможной причиной дефекта является воздействие вирусных и токсических мутагенов на 8 неделе гестации.
- Дисплазия соединительной ткани. Наследуемое нарушение синтеза и пространственной организации коллагена, эластина, белково-углеводных комплексов проявляется снижением прочности и повышением эластичности соединительнотканных волокон. При повышении нагрузок на диафрагмальные участки с ослабленными волоконными структурами возможно их растяжение, формирование дефектов. Подтверждением диспластического происхождения части грыж диафрагмы считается сочетание патологии с варикозной болезнью, геморроем, миопией, сколиозом, другими врожденными коллагенопатиями.
- Травматические повреждения диафрагмы. Нарушение целостности диафрагмальных волокон наблюдается при резких ударах в область ребер и живота со значительным смещением пищевода, верхней части желудка, проникающих колотых, режущих, огнестрельных ранах грудной и брюшной полости. У части пациентов грыжа развивается после выполнения операций на диафрагме – чресплевральной, сагиттальной, срединной чрезбрюшинной диафрагмотомии, проводимой для ревизии органов верхнего этажа брюшной полости, при раке желудка, пищевода, резекции печени, дренировании заднего средостения и др.
- Повышение давления в брюшной полости. Играет ключевую роль при наследственной дисплазии соединительной ткани. Вероятность образования грыжи возрастает при тяжелых физических нагрузках, запорах, ожирении, крупных неоплазиях брюшных органов, асцита. Наличие диафрагмальных грыжевых образований подтверждается почти у половины пациентов, страдающих рецидивирующей бронхолегочной патологией с сухим надсадным кашлем (хроническим бронхитом, бронхиальной астмой). В группу риска входят женщины, выносившие многоплодную беременность или родившие нескольких детей.
- Хронические заболевания ЖКТ. Язва желудка, двенадцатиперстной кишки, хронический холецистит, панкреатит могут осложняться гипермоторной дискинезией. В результате продольных сокращений мускулатуры пищевода происходит вертикальная тракция органов ЖКТ, увеличивается нагрузка на фасциальные связки, диафрагмальные сухожилия, растягивается пищеводное отверстие диафрагмы. Аналогичная ситуация возникает при хронических эзофагитах со стойким воспалительным спазмом мышечных волокон или рубцовом укорочении органа после химических, термических, лучевых ожогов.
По мнению ряда авторов, образованию грыж способствует возрастное снижение тонуса диафрагмальных мускульных волокон, мышечная дистрофия после осложненных родов, тяжелых интоксикаций, сепсиса, других неотложных состояний. При нарушениях иннервации происходит локальная релаксация мышцы с образованием так называемых диафрагмальных невропатических грыж.
Патогенез
В основе механизма диафрагмального грыжеобразования лежит расширение естественных отверстий, наличие или возникновение патологических дефектов в диафрагме с перемещением через них в торакальную полость пищеварительных органов. Из трех анатомических отверстий в формировании грыжевых выпячиваний участвует только пищеводное, через которое внутрь грудной полости втягивается гастроэзофагеальный переход с кардиальной частью желудка (скользящая диафрагмальная грыжа) либо желудочное дно, тело, реже – другие отделы органа, петли тонкого кишечника (параэзофагеальная грыжа).
При аплазии мышечных волокон, врожденном расщеплении соединительной ткани в так называемых слабых зонах (люмбокостальная грыжа Бохдалека, ретрокостостернальная грыжа Ларрея-Морганьи, ретростернальные грыжи) дефект диафрагмы существует изначально. Травматические воздействия, высокое абдоминальное давление, локальное мускульное расслабление провоцируют образование патологических диафрагмальных отверстий.
Нетравматические приобретенные грыжевые выпячивания чаще возникают при врожденных коллагенопатиях, способствующих растяжению сухожильных волокон и фасциальных связок. Смещение брюшных органов, их сдавление краями диафрагмальных отверстий, компрессия легких и сердца приводят к формированию характерной клинической картины заболевания.
Классификация
Систематизация форм диафрагмальных грыж учитывает время их возникновения, структуру грыжевого выпячивания, этиологию, локализацию. Такой подход обоснован различием клинической симптоматики, прогноза, врачебной тактики при разных видах заболевания. С учетом основных критериев классификации гастроэнтерологи и общие хирурги различают следующие варианты патологии:
- По времени возникновения: врожденные и приобретенные грыжи. Наследственные и дизонтогенетические грыжевые образования встречаются реже, однако отличаются более тяжелой клиникой и серьезным прогнозом. Грыжи, сформировавшиеся постнатально, зачастую протекают с менее выраженными клиническими симптомами или латентно.
- По структуре грыжевого выпячивания: истинные и ложные грыжи. У истинных грыж есть грыжевой мешок, образованный пристеночными брюшиной и плеврой. У ложных грыжевой мешок отсутствует, а смещенные брюшные органы свободно двигаются внутри грудной клетки. Прогностически более благоприятными считаются истинные грыжевые образования.
- По происхождению и локализации: травматические и нетравматические грыжи. Нетравматические выпячивания бывают ложными врожденными, истинными слабых зон, истинными атипичной локализации, скользящими и параэзофагеальными пищеводного отверстия диафрагмы. В 90% случаев патология представлена грыжами в области отверстия пищевода.
Симптомы диафрагмальных грыж
Клинические проявления заболевания связаны с нарушением работы ЖКТ, дыхательной и сердечно-сосудистой систем. Возможные диспепсические расстройства при грыже представлены отрыжкой воздухом или кислым, постоянной изжогой, которая может усиливаться после еды или при наклонах туловища, метеоризмом, рвотой, не приносящей облегчения.
Характерный симптом – «бульканье» или урчание в груди. Вследствие раздражения диафрагмальных нервов пациентов беспокоят интенсивные загрудинные боли, иррадиирующие в плечо. Также наблюдается тахикардия после приема пищи, одышка, трудности при проглатывании жидкой пищи, ощущение «комка». При небольшом размере грыжи симптоматика болезни может отсутствовать или быть очень скудной.
Для врожденной патологии характерно развитие клинической картины уже в период новорожденности. Клиника зависит от размеров дефекта диафрагмальных тканей. При тяжелом течении симптоматика возникает в первые часы после родов и включает такие проявления, как цианоз кожных покровов, асимметрия грудной клетки, срыгивания, отказ от кормления, дефицит массы тела, нарушения сна, постоянный плач.
У части младенцев из-за смещения брюшных органов формируется ладьевидный живот. При небольших грыжевых отверстиях симптомы грыжи развиваются позже, иногда в позднем детстве после перенесенного инфекционного энтерита, напоминают клинику заболевания у взрослых.
Осложнения
Вследствие расширения пищеводных вен могут возникать острые кровотечения, проявляющиеся кровавой рвотой или меленой. У 50% больных из-за постоянного попадания агрессивного содержимого желудка на слизистую нижней трети пищевода диафрагмальная грыжа эзофагеального отверстия осложняется рефлюкс-эзофагитом (ГЭРБ). Длительное течение ГЭРБ сопровождается метаплазией эпителия с последующей возможной малигнизацией клеток.
Сдавление грыжевого мешка в диафрагмальном отверстии провоцирует ущемление грыжи, при котором наблюдаются процессы ишемии и некроза тканей смещенных органов, возрастает риск вовлечения в деструктивно-воспалительный процесс брюшины с развитием перитонита. В редких случаях грыжа осложняется аспирационной пневмонией. При длительном сдавлении легких, сердца нарастает дыхательная и сердечная недостаточность.
Диагностика
Постановка диагноза диафрагмальной грыжи зачастую затруднена, что обусловлено многообразием и неспецифичностью клинических проявлений, которые могут наблюдаться при других патологических состояниях. Диагностический поиск направлен на подтверждение наличия выпячивания, оценку содержимого грыжевого образования. План обследования пациента включает такие методы, как:
- Рентгенография грудной клетки. Проведение рентгенологического исследования ОГК с контрастным веществом в положении больного по Тренделенбургу считается «золотым стандартом» для диагностики грыжи. Рентгенограмма позволяет оценить локализацию и размеры диафрагмального дефекта, визуализировать интраторакальное проникновение органа или его части.
- Эзофагогастроскопия. Гастроскопия обеспечивает осмотр слизистой оболочки верхних отделов пищеварительного тракта, оценку степени ее повреждения. О наличии грыжи косвенно свидетельствует укорочение расстояния до нижнего пищеводного сфинктера, неполное смыкание кардии желудка, сглаженность складок слизистой клапана Губарева.
- Определение кислотности. Внутрипищеводная рН-метрия помогает верифицировать диагноз рефлюкс-эзофагита, который является самым распространенным осложнением грыжи диафрагмы. Дополнительно проводится кислотно-перфузионный тест Бернштейна с введением в пищевод слабого раствора соляной кислоты, что вызывает усиление симптомов у больных с ГЭРБ.
Лабораторные исследования при грыже диафрагмы недостаточно информативны, поскольку отклонения показателей от нормы обусловлены присоединившимися осложнениями. Для комплексной оценки состояния пищеварительной системы рекомендованы УЗИ, КТ, МСКТ брюшной полости. С целью исключения сердечной патологии выполняется ЭКГ с велоэргометрической пробой, эхокардиография.
Грыжи диафрагмы необходимо дифференцировать с язвой желудка, пилоростенозом, кишечной непроходимостью, рубцовыми эзофагеальными стриктурами, злокачественными новообразованиями пищевода, кардии, ишемической болезнью сердца, абсцессами и кистами легких, экссудативным плевритом, легочной формой туберкулеза, опухолями средостения, повреждениями диафрагмального нерва.

КТ ОБП. Диафрагмальная грыжа Бохдалека слева, связанная с истончением мышцы диафрагмы в задне-медиальных отделах с пролабированием забрюшинной клетчатки в краниальном направлении.
Лечение диафрагмальных грыж
Радикальным методом, позволяющим излечить заболевание, является герниопластика. От операции можно воздержаться при выявлении бессимптомной скользящей грыжи эзофагеального отверстия диафрагмы, обеспечив пациенту диспансерное наблюдение. В остальных случаях смещенные органы в ходе хирургического вмешательства низводятся в брюшную полость, после чего устраняется диафрагмальный дефект при ложных грыжевых образованиях или выполняется пластика при истинных. Новорожденным с выраженной компрессией органов грудной полости операция осуществляется в экстренном порядке. У взрослых герниопластику обычно проводят планово.
При длительно существующих грыжах, осложненных хроническими заболеваниями органов ЖКТ, рекомендовано комбинированное лечение с коррекцией диеты, назначением противоязвенной, противовоспалительной, заместительной энзимной, антибактериальной, прокинетической, спазмолитической, другой этиопатогенетической и симптоматической медикаментозной терапии. Рекомендованными видами вмешательств являются:
- Эндоскопические методики. Лапароскопическая фундопликация применим при грыжевом выпячивании через эзофагеальное отверстие диафрагмы. Формирование околопищеводной муфты из дна желудка с фиксацией к диафрагме и сужением диафрагмального отверстия позволяет устранить грыжевой дефект и восстановить запирательную функцию кардиального сфинктера. Преимуществами лапароскопического вмешательства являются низкая травматичность, сокращение длительности операции, более быстрое послеоперационное восстановление пациента.
- Лапаротомная и торакотомная герниопластика. При параэзофагеальных и скользящих грыжах выполняют гастрокардиопексию, операцию Белси, фундопликацию по Ниссену, Тупе. У остальных пациентов при небольших диафрагмальных отверстиях целостность ткани восстанавливают методом создания дупликатуры. Для устранения больших дефектов проводят аллопластику с установкой нейлонового, тефлонового, капронового протеза. Грыжесечение ущемленной грыжи предполагает ревизию содержимого грыжевого мешка с резекцией нежизнеспособных тканей.
Прогноз и профилактика
При ранней диагностике и адекватной терапии выздоровление наступает у большинства больных. Прогноз относительно благоприятный. В дальнейшем повышается риск развития рецидивов грыжи, особенно после оперативного вмешательства по укреплению диафрагмальных отверстий аллотрансплантатом.
Меры профилактики врожденной формы заболевания не разработаны, однако благодаря УЗИ-скринингу и дородовому выявлению патологии удается снизить риск перинатальной смертности. Для предупреждения развития приобретенной диафрагмальной грыжи необходимо проводить своевременное лечение хронических болезней органов пищеварения и состояний, сопровождающихся повышением внутрибрюшного давления, избегать травм живота и грудной клетки.
Источник
Медикаментозная терапия
В 80-90-х годах ХХ столетия заметно уменьшилось количество больных, нуждающихся в хирургическом лечении. Это было связано с появлением новых антисекреторных, антацидных и прокинетических препаратов. За последнее десятилетие разработанные схемы медикаментозного лечения в значительной степени уменьшили риск развития осложнений и повысили качество жизни больных с рефлюкс-эзофагитом легкой и средней степени тяжести. Однако главной проблемой консервативного лечения было и остается почти полный рецидив заболевания после прекращения очередного курса медикаментозной терапии. Несвоевременное выполнение операции по поводу рефлюкс-эзофагита и ГПОД связано во многом с тем, что у хирургов и терапевтов-гастроэнтерологов до сих пор нет единой точки зрения на тактику лечения больных с этими патологическими состояниями. Продолжаются споры о показаниях к его хирургическому лечению и своевременности перехода от консервативного лечения к оперативному. Особенно дискутабельными остаются вопросы выбора тактики лечения при легкой и средней степени выраженности рефлюкс-эзофагита.
Нежелательным является прием препаратов, снижающих тонус НПС (теофиллина, прогестерона, антидепрессантов, нитратов, простагландинов, антагонистов кальция, β-адреноблокаторов, антихолинэргических препаратов), а также оказывающих неблагоприятное действие на слизистую оболочку пищевода (нестероидные противовоспалительные средства, доксициклин, хинидин).
Медикаментозное лечение должно быть направлено на снижение кислотности желудочного сока, нейтрализацию выработанной соляной кислоты и ускорение эвакуации пищи из желудка. С этой целью терапия может включать в себя применение различных групп препаратов.
Антацидные препараты (альмагель, маалокс, фосфалюгель, гастал и пр.) и алгинаты (гавискон, топалкан и пр.) по быстроте достижения терапевтического эффекта (купирование боли и изжоги) превосходят остальные лекарственные препараты. Антациды назначают в симптоматических целях, действие их направлено на нейтрализацию кислоты и, к сожалению непродолжительно. Основными их действующими компонентами являются гидроокись алюминия, трисиликат магния, нитрат висмута. Некоторые из вышеназванных комплексных антацидов выпускаются в таблетках, другие – в виде геля. Частота их приема определяется выраженностью клинических симптомов, обычно 4-5 раз в день в перерывах между приемами пищи и перед сном. Достоинством этих препаратов являются хорошая переносимость большинством пациентов и быстрота наступления клинического эффекта.
Существуют, однако, и неблагоприятные последствия приема антацидных преапартов. В частности алюминий-содержащие препараты при длительном их применении могут вызывать гипофосфатемию и запоры. После ряда химических превращений эти препараты образуют в кишечнике человека выделяющиеся с калом малорастворимые соединения, в состав которых входит фосфор. Избежать этого позволяет назначение фосфорсодержащих средств (например, фосфалюгеля, однако его ощелачивающая способность меньше, чем у альмагеля).
Массивная терапия карбонатом кальция приводит к алкалозу и противопоказана при гиперкальциемии, остеохондрозе, наличии кальцийсодержащих конкрементов в почках и желчном пузыре.
С учетом важной роли нарушения моторики пищевода и желудка в патогенезе РЭ существенное место в лечении таких пациентов занимают прокинетики – препараты, нормализующие моторику желудочно-кишечного тракта, улучшающие функцию нижнего пищеводного сфинктера. Прокинетики повышают давление НПС, улучшают пищеводный клиренс и опорожнение желудка.
Блокаторы H2-рецепторов гистамина. Появление этой группы препаратов открыло эру эффективной медикаментозной терапии, позволяющих снизить секрецию соляной кислоты. Появившиеся в 1970-х годах, они сыграли большую роль в лечении язвенной болезни желудка и двенадцатиперстной кишки. Однако эти препараты были менее эффективны в лечении рефлюкс-эзофагита. В настоящее время существует 5 поколений Н2-блокаторов: I поколение – циметидин; II – поколение – ранитидин; III поколение – фамотидин; IV поколение – низатидин; V поколение – роксатидин. В настоящее время наиболее широко применяются препараты из группы ранитидина (зантак, ранитин) и фамотидина (квамател, фамосан, гастромсидин), которые назначают в основном при катаральных формах РЭ. Эти препараты эффективно снижают базальную секрецию соляной кислоты в желудке и ингибируют секрецию пепсинов. При лечении пациентов с эрозивными формами заболевания они часто оказываются недостаточно эффективными даже при приеме удвоенных доз (600 мг ранитидина и 80 мг фамотидина в сутки) и потому уступили свое место ингибиторам H+,K+-АТФазы (ингибиторы протонной помпы), являющимся в настоящее время наиболее сильными антисекреторными препаратами.
Ингибиторы протонной помпы (омепразол, ланзопразол и пантопразол) были введены в клиническую практику в конце 1980-х годов [7]; рабепразол и эзомепразол появились не так давно. Назначаемые, как правило, также в удвоенных дозах (омепразол 40 мг, лансопразол 60 мг, пантопразол 80 мг), они позволяют достичь заживления эрозий пищевода у 85-90% больных, в том числе и резистентных к Н2-блокаторам. Препараты этой группы практически лишены побочных эффектов поскольку в активной форме существуют только в париетальной клетке.
Вместе с тем, последние исследования показали, что при использовании рекомендуемой обычно терапевтической дозы омепразола (20 мг 2 раза в сутки) примерно у 20% больных РЭ сохраняются выраженные изменения внутрипищеводного рН, а почти у 1/3 больных для получения терапевтического эффекта требуется применение доз омепразола, значительно превышающих стандартные терапевтические дозы (до 140 мг в сутки).
Основной курс лечения обострений РЭ (особенно эрозивно-язвенных форм РЭ) требует не менее 8-12 нед. При этом прекращение приема лекарственных препаратов после достижения заживления эрозий пищевода приводит у многих больных к быстрому возникновению рецидива заболевания. Поэтому многим больным показан поддерживающий прием блокаторов протонного насоса или прокинетиков (в половинных суточных дозах) в течение как минимум 1 года, который позволяет сохранить ремиссию заболевания у большинства пациентов.
Осложнения приема антисекреторных препаратов.
По данным последних публикаций число больных, частично или полностью не ответивших на стандартную дозу ИПП (1 раз в день в течение 8 недель) составляет 40-50%.
Описанный в литературе «синдром рикошета» приводит к резкому повышению желудочной секреции после отмены антисекреторной терапии вследствие гипергастринемии. Отмечено развитие синдрома «рикошета» уже после 2-4 недель приема H2-блокаторов и 6-8 недель приема ИПП. Безусловно резкое повышение секреции кислоты может спровоцировать возникновение острой язвы, однако эта вероятность выше при использовании H2-блокаторов.
Существующий так же «синдром усталости» рецепторов является клинически значимым и характерным для всех препаратов группы блокаторов H2-гистаминовых рецепторов. Известно, что через 5-7 дней непрерывного приема Н2-блокаторов эффективность терапевтических доз снижается более чем на 50%, а при более длительном использовании антисекреторный эффект и вовсе утрачивается.
В литературе описан феномен «ночного кислотного прорыва» – снижение рН в желудке ниже 4,0 в течение нескольких часов в период с 22 до 6 часов на фоне приема ИПП. Развитие этого феномена выявлено почти у 70% больных с рефлюкс-эзофагитом и 80% больных с пищеводом Барретта, и, вероятно, связано с увеличением активности блуждающих нервов в это время и снижением образования слизи добавочными клетками
Проведённые исследования показывают, что при длительном применении антисекреторные препараты вызывают развитие атрофического гастрита с кишечной метаплазией у пациентов с конкурентной инфекцией Helicobacter pylori, что более подробно описано в соответствующей главе.
Многие авторы подтверждают увеличение в 2-3 раза риска развития диареи, вызванной Clostridium difficile на фоне длительной терапии ИПП.
Взаимосвязь длительного приема ИПП и возникновения переломов все еще остается дискутабельной. В обзоре L. Laine были сопоставлены данные 13556 больных с переломами бедра старше 50 лет и 135386 лиц, составивших группу контроля, сопоставимых по полу, возрасту на предмет приема ИПП. Было показало увеличение риска перелома бедра при приеме ИПП более года, при этом наибольший риск отмечался при длительном приеме ИПП в высокой (> 1,75) ежедневной дозе.
Больные с гастроэзофагеальным рефлюксом, длительное время принимающие антисекреторные препараты находятся в группе риска возникновения пневмонии
Консервативные мероприятия у больных с осложнениями рефлюкс-эзофагита часто являются одновременно предоперационной подготовкой. Бужирование у больных с пептической стриктурой пищевода необходимо проводить под прикрытием массивной противоязвенной терпи. Поскольку на фоне механического повреждения и раздражения происходит обострение хронического эзофагита, а расширение стриктуры облегчает гастроэзофагеальный рефлюкс необходимо незамедлительное антирефлюксное вмешательство вскоре после завершения курса бужирований.
Источник
